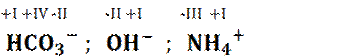Oxidationszahlen für die Interpretation
von
Redoxreaktionen
Begriff
Man behandelt alle in Redoxreaktionen
auftretenden Stoffe so, als ob sie aus Ionen
aufgebaut
wären. Dabei ordnet man die Elektronen einer Atombindung jeweils ganz
dem Bindungspartner mit der höheren Elektronegativität zu.
Die dabei entstehenden Ladungen heißen
Oxidationszahlen.
Beispiele
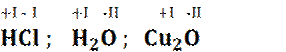
LSG
Regeln zur Bestimmung von Oxidationszahlen
( die dargestellte Reihenfolge ist stets
einzuhalten )
(1) Elemente erhalten die Oxidationszahl 0.
(2) Bei Ionen, die aus einem Atom entstehen,
ist die Oxidationszahl gleich der mit
einem Vorzeichen der Ladung versehenen Ladungszahl.
( Hauptgruppennummer bei Metallen; 8 –
Hauptgruppennummer bei Nichtmetallen )
(3)
In Molekülen einer Verbindung
haben
Wasserstoffatome meist die
Oxidationszahl +I
Sauerstoffstoffatome meist die
Oxidationszahl -II
Halogenatome meist die
Oxidationszahl –I
(4) Die Summe der Oxidationszahlen ist in
Molekülen stets 0.
Die Summe der Oxidationszahlen ist in zusammengesetzten Ionen stets der
Ionenladung.
Damit ergibt sich meist
auch eine fehlende Oxidationszahl.
Beispiele
Bei Regel
1 : Bei den Elementen erhalten die Atome die
Oxidationszahl 0.
![]()
Regel 2 : Bei den
einfachen Ionen ist die Oxidationszahl gleich der Ladungszahl.
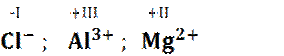
Regel 3 : In den Molekülen einer
Verbindung haben meist
Wasserstoff - Atome die Oxidationszahl +I
Sauerstoff - Atome die Oxidationszahl -II
Halogenatome - Atome die Oxidationszahl -I.
Regel 4 : Die
Summe aller Oxidationszahlen ist 0.
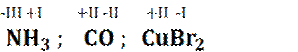
Regel 4 : In den
zusammengesetzten Ionen ist die Summe aller Oxidationszahlen
gleich der Ionenladung.