Reaktionstypen
in
der anorganischen Chemie
Redoxreaktion
Das Wesen der Redoxreaktion ist der
Übergang des kleinsten Anions ( negativ geladenen Ions ), dem Elektron.
Redoxreaktionen sind Reaktionen mit Veränderungen der
Oxidationszahlen
( Elektronenübergänge ).
Die Oxidation ist die Teilreaktion mit der
Erhöhung der Oxidationszahl
( Elektronenabgabe ).
Die Reduktion ist die Teilreaktion mit der
Erniedrigung der Oxidationszahl
(
Elektronenaufnahme ).
Beispiel Reaktion
von Chlorwasserstoff mit Sauerstoff
(1)
Ermittlung aller
Oxidationszahlen
![]()
![]()
Oxidation
Reduktion
(2) Bei der
Oxidation erfolgt die Elektronenabgabe, das bedeutet eine Erhöhung der
Oxidationszahl
bei Chlor
viermal -I ® 0 also
: +
4e-
(3) Bei der Reduktion erfolgt eine
Elektronenaufnahme, das bedeutet eine Erniedrigung
der Oxidationszahl
bei Sauerstoff zweimal 0 ® -II also
: -
4e-
(4) Bei Redoxreaktion erfolgt eine Veränderung der Oxidationszahlen.
Reduktionsmittel ( Elektronendonator;
Erhöhung der Oxidationszahl ): Chlorwasserstoff
Oxidationsmittel ( Elektronenakzeptor;
Erniedrigung der Oxidationszahl ): Sauerstoff
Säure-Base-Reaktion
Das Wesen der Säure-Base-Reaktion ist
der Übergang des kleinsten Kations ( positiv geladenen Ions ), dem Proton.
Säure-Base-Reaktionen sind Reaktionen ohne Veränderungen der
Oxidationszahlen
(
Protonenübergänge ).
Die Säurereaktion ist die Teilreaktion mit
der Abgabe von Protonen.
( Säuren sind Protonendonatoren ).
Die Basereaktion
ist die Teilreaktion mit der Aufnahme von Protonen.
( Basen sind Protonenakzeptoren
).
Beispiel Reaktion
von Chlorwasserstoff mit Wasser
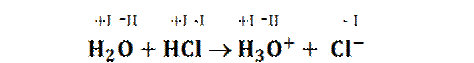
![]()
H+ - Übergang (
Protonenübergang )
Bei
Säure-Base-Reaktionen erfolgt keine Veränderung
der Oxidationszahlen.
Säure ( Protonendonator
): Chlorwasserstoff
Base ( Protonenakzeptor ): Wasser
Fällungsreaktion
Das Wesen der Fällungsreaktion ist das
Vereinigen von Kationen ( positiv geladenen
Ionen ) und Anionen ( negativ geladenen
Ionen ) zu schwer wasserlöslichen salzartigen
Verbindungen.
Fällungsreaktionen sind Reaktionen ohne Veränderungen der
Oxidationszahlen
und ohne Protonenübergänge.
Beispiel Reaktion von Silber-Ionen und Chlorid-Ionen
in wässrigen Lösung
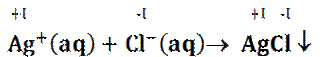
keine Änderung der Oxidationszahlen
also kein Elektronenübergang
kein Protonenübergang
Komplexreaktion
Ein
Komplex besteht aus Zentralteilchen
und den Liganden.
In
Komplexen sind in der Regel um positiv geladene
Metall-Ionen ( Kationen ) oder Metall-Atome negativ
geladene Anionen oder ( Dipol- ) Moleküle symmetrisch angeordnet. Bei
Komplexverbindungen existiert oft ein negativ geladenes Anion als Gegen-Ion.
Komlexbildungsreaktion
Betrachtet
man auch die hydratisierten Ionen als Aquo-Komplexe
treten fast ausschließlich als Reaktionen solche unter Austausch der
Wassermoleküle statt:
Ligandenaustauschreaktion
Das Wesen der Komplexreaktion ist das
Vereinigen von Kationen ( positiv geladenen
Ionen ) oder Atomen und Anionen (
negativ geladenen Ionen ) oder Dipolmolekülen zu leicht wasserlöslichen, meist charakteristisch
gefärbten salzartigen Verbindungen.
Komplexreaktionen sind Reaktionen ohne Veränderungen der
Oxidationszahlen
und ohne Protonenübergänge.
Beispiel Reaktion von Kupfer-(II)-Ionen und Ammoniak
in wässrigen Lösung
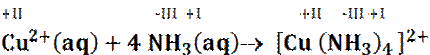
Oder ![]()
bzw.
![]()
hellblau tiefblau
keine Änderung
der Oxidationszahlen
also kein Elektronenübergang
kein Protonenübergang
oft Änderung der Farbe